电导率法是测试PVC降解脱除氯化氢速度和质量的一种很有效的方法,而活化能(Ea)的大小又直接反应化学反应速率的大小,因此,本文利用电导率法分别在180℃(453.15K)和195℃(468.15K)条件下测试了PVC热稳定体系的电导率,并通过归一化法得出了180℃和195℃条件下PVC的降解速率,然后利用阿伦尼乌斯公式推出了PVC降解反应的活化能,因为Ea是化学反应的能垒,因此活化能越大,反应速率越小,反应越难进行,也即PVC热稳定体系稳定效果越好[54],实验结果如图3-12(I-II)和表3-13所示。
当实验温度为180oC时纯PVC、PE/La2O3、CaSt2/ZnSt2和季戊四醇镧的诱导时间分别为18.8min、24.6min、
当实验温度为195oC时纯PVC、PE/La2O3、CaSt2/ZnSt2和季戊四醇镧的诱导时间分别为9.0min、10.4min、12.4min和24.9min,热稳定时间分别为12.2min、13.1min、14.7min和28.8min。
由图3-12可知,195oC条件下PVC电导率/时间曲线的斜率显著大于180oC条件下的斜率,也即升高温度PVC降解速率显著增大,因此,PVC的降解符合阿伦尼乌斯公式。PVC降解反应为一级不可逆反应,因此每个反应都具有一个正的活化能,本文运用阿伦尼乌斯公式对PVC降解的活化能进行计算。阿伦尼乌斯公式如下:
k1:453.15K的降解速率系数;k2:468.15K的降解速率系数;Ea:活化能(kJ/mol)R:摩尔气体常数(8.314J/(K·mol));T1:凯氏温度453.15K;T2:凯氏温度468.15K。降解速率系数等于电导率/时间曲线的斜率,从表3-12可以看出纯PVC的Ea为90.5kJ/mol,随着稳定剂的加入活化能Ea逐渐增大,PE/La2O3为 140.2kJ/mol,CaSt2/ZnSt2为147.8kJ/mol,而当有季戊四醇镧加入时活化能Ea最大,能达到278.0kJ/mol。
因此,季戊四醇镧能很有效的抑制PVC的降解。
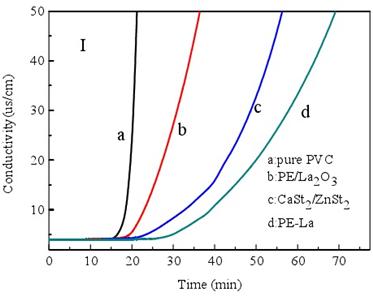
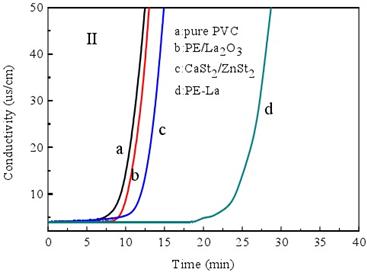
图3-12 水溶液电导率随时间的变化规律曲线:I:180℃; II:195℃.
表3-13 180℃和195℃条件下的电导率数据
.png)
 苏公网安备 32128202000333号
苏公网安备 32128202000333号